LATIHAN 3
1. Sifat
koligatif larutan adalah sifat yang bergantung pada ….
A.
Jenis zat terlarut
B.
Jenis zat pelaut
C.
Jumlah zat pelarut
D. Jumlah zat terlarut
E.
Konsentrasi larutan
Pembahasan
Sifat koligatif larutan adalah
sifat-sifat yang hanya tergantung pada Jumlah (kuantitas) partikel zat terlarut
dalam larutan dan tidak bergantung pada jenis atau identitas partikel zat
terlarut, tidak peduli dalam bentuk otom, ion, ataupun molekul. Sifat koligatif
merupakan sifat yang hanya memandang “kuantitas” bukan “kualitas”.
2. Salah
satu yang akan di sebebkan oleh keberadaan zat terlarut dalam pelarut adalah ….
A.
Tekanan uap jenuh lebih tinggi daripada tekanan
uap jenuh pelarut
B.
Titik beku larutan lebih tinggi daripada titik
beku pelarut
C.
Tekanan osmosis larutan lebih rendah dari
tekanan osmosis pelarut
D. Titik didih larutan lebih tinggi daripada
titik didih pelarut
E.
Titik didih pelarut lebih tinggi dari pelarutnya
Pembahasan
Keberadaan zat terlarut dalam
pelarut dapat mengakibatkan terjadinya kenaikan titik didih larutan,karena
terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut tersebut.
Sehingga dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan
sehingga sama dengan tekanan eksternal.
3. Larutan
fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/ml. Berapa
kemolala larutan
adalah …. (Mr fruktosa = 180)
A.
1,75 mol/kg
B.
1,87 mol/kg
C. 1,77 mol/kg
D.
1,85 mol/kg
E.
1,90 mol/kg
Pembahasan
Basis perhitungan 1 L larutan
fruktosa
Kemolalan laerutan fruktosa, m =
n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa =
1,476 mol
– menghitung massa air, w air = w
larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa =
n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w
fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
4. Fraksi
mol larutan methanol CH3OH dalam air adalah 0,50. Kosentrasi methanol dalam
arutanini dinyataan dalam persen berat methanol adalah …. Ar C = 12, O = 16, H
=1
A. 64 %
B.
54%
C.
63%
D.
62%
E.
60%
Pembahasan
KUIS 3
Chapter 1
1. Perhatikan gambar pengujian daya hantar beberapa larutan ini!
Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut adalah….
A. 1 dan 2
B. 1 dan 3
C. 1 dan 5
D. 2 dan 3
E. 4 dan 5
2. Kegiatan dengan menggunakan panca indra untuk mendapatkan informasi tentang sesuatu disebut ….
A. Observasi
B. Bertanya
C. Meramal
D. Mengumpulkan informasi
E. Mencari literatur
Chapter 2
1. Pada isotop unsur , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Pembahasan
· X = lambang unsur
· Z = jumlah proton
· N = nomor atom
· M = massa atom
· Neutron = A – Z
2. Kelemahan teori atom Niels Bohr adalah . . .
A. tidak dapat menjelaskan spektrum unsur hidrogen
B. bertentangan dengan hukum – hukum fisika klasik dar Maxwell
C. tidak dapat menentukan posisi elektron dengan pasti
D. bertentangan dengan teori atom Dalton bahwa atom – atom suatu unsur identik
E. tidak dapat menentukan perubahan energi pada perpindahan elektron dalam atom
Pembahasan
Kelemahan teori atom Niels Bohr adalah tidak dapat menetukan posisi elektron dengan pasti , karena posisi elektron ditentukan setelah adanya bilangan kuantum.
Chapter 3
1. Sebanyak 4,0 gram cuplikan yang mengandung senyawa hidrokarbon dibakar sempurna dengan gas oksigen. Jika presentase (%) massa karbon dalam cuplikan tersebut adalah 30%, maka massa karbon dioksida yang dihasilkan dalam proses pembakaran tersebut adalah.... (Ar C = 12, O = 16)
A. 3,3
B. 4,4
C. 5,4
D. 5,5
E. 6,0
Pembahasan
dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:
2. Suatu cuplikan yang mengandung pirit (FeS) seberat 88 gram bereaksi dengan HCl sehingga menghasilkan FeCl2 dan gas H2S. Jika dihasilkan produk berupa 15 L H2S yang diukur pada saat 2,5 L gas Nitrogen bermassa 3,5 gram, maka persentase massa FeS pada cuplikan tersebut adalah....
(Ar Fe = 56, Cl = 35,5, H = 1, S = 32, N = 14)
A. 25%
B. 35%
C. 45%
D. 75%
E. 90%
Pembahasan
FeS + 2HCl → FeCl2 H2S
Jumlah gas H2S yang dihasilkan dari reaksi diukur pada keadaan gas Nitrogen → Hukum Avogadro
Karena koefisien FeS = koefisien H2S, maka mol FeS = mol H2S. Sehingga :
nH2S = nFeS = 0,75 mol
massa FeS = (0,75 mol x 88 gram/mol)
massa FeS = 66 gram
Chapter 4
1. Perhatikan reaksi berikut ini!
1) HF + H2O -> F- + H3O+
2) NH3+ H2O -> NH4+ + OH-
3) C6H5COOH + H2O -> C6H5COO- + H3O+
4) RNH2+ H2O -> RNH3 + OH-
Air merupakan salah satu zat yang bersifat amfoter, artinya dapat bertindak sebagai asam maupun basa. Reaksi yang menunjukkan air bertindak sebagai basa adalah ….
A. 1, 2, dan 3
B. 1 dan 3
C. 2 dan 4
D. 4 saja
E. 1, 2, 3, 4
Pembahasan
Asam Basa Bronsetd-Lowry adalah pasangan asam basa yang hanya berbeda pada satu atom H saja. Asam memiliki atom H lebih banyak dibandingkan basa.
Pada reaksi (1) HF + H2O -> F- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
Pada reaksi (3) C6H5COOH + H2O -> C6H5COO- + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
2. Logam Natrium dapat diperoleh dengan cara mengelektrolisis lelehan NaCl menggunakan elektroda inert, massa logam Natrium yang dihasilkan di katoda dari elektrolisis lelehan NaCl selama 20 menit dengan kuat arus 5 A adalah sebesar …. (Ar Na = 23 gr/mol; Cl = 35,5 gr/mol)
A. 1,43 gr
B. 2,35 gr
C. 3,75 gr
D. 5,23 gr
E. 6,44 gr
Pembahasan
Pada elektrolisis lelehan NaCl terjadi reaksi sebagai berikut:
Katoda : Na+ (aq) + e → Na (s)
Perubahan biloks = 1
Massa logam yang diendapkan di katoda adalah logam Na:
Chapter 5
1. Gas mulia yang terbanyak di atmosfer adalah. . .
A. Helium
B. Neon
C. Argon
D. Kripton
E. Xenon
Pembahasan
Gas mulia yang terdapat di atmosfer adalah argon. Argon diurutan ketiga setelah nitrogen dan oksigen.
2. Manakah sifat gas mulia yang makin berkurang dengan bertambahnya nomor atom. . .
A. Energi ionisasi
B. Volume atom
C. Titik didih
D. Titik leleh
E. Keelektronegatifan
Pembahasan
· Jari-jari atomnya semakin besar, akibatnya dari He ke Rn semakin mudah membentuk dipol sesaat dan gaya van der waals semakin kuat.
· Semakin kuatnya gaya van der waals (dari He ke Rn) menyebabkan titik didih dan titik leleh gas mulia dari atas ke bawah semakin tinggi.
· Energi ionisasinya semakin kecil, bahkanuntuk Xe dan Rn mempunyai energi ionisasi yang lebih rendah dari hidrogen (energi ionisasi hidrogen: 1.312 kJ/mol)
Chapter 6
1. Sebuah Kristal KNO3 dimasukkan ke dalam tabung reaksi kemudian ditetesi dengan air. Pada tabung reaksi terasa dingin. Reaksi ini dapat digolongkan….
A. Eksoterm, energi berpindah dari sistem ke lingkungan
B. Eksoterm, energi berpindah dari lingkungan kesistem
C. Endoterm, energi berpindah dari sistem ke lingkungan
D. Endoterm, energi berpindah dari lingkungan ke sistem
E. Endoterm, energi tidak berpindah
Pembahasan
Pada percobaan tersebut dikatakan endoterm, karena pada saat KNO3 beraksi dengan air, temperature nya turun karena tabung reaksi terasa dingin. Setelah sampai pada titik terendah, lama-kelamaan temperature akan naik kembali sampai temperature awal.
Penurunan temperature pada saat KNO3 bereaksi dengan air, menunjukkan bahwa reaksi menyerap kalor . Pada reaksi endoterm reaksi yang menyerap kalornya berpindah dari lingkungan ke sistem, sehingga kalor dari sistem akan bertambah. Sehingga lingkungannyaa terasa dingin atau pada soal lingkungannya tabung reaksi.
2. Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
A. 740 kJ
B. 470 kJ
C. 740 kJ
D. 470 kJ
E. 740 kJ
Pembahasan
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
= 15.740 kJ
Chapter 7
1. Spesi yang memiliki jumlah electron yang sama dengan atom 10Ne adalah . .. .
A. 11Na
B. 12Mg+2
C. 16S-2
D. 17Cl–
E. 17Cl
Pembahasan
Jumlah electron pada atom Ne = 10
Ingat jika atom membentuk io positif maka artinya telah melepas electron sehingga jumlah elektronnya berkurang, sedangkan jika atom membentuk ion negative maka artinya telah menangkap electron sehingga jumlah elektronnya bertambah.
11Na = jumlah electron = 11
12Mg+2 = jumlah electron = 12 – 2 = 10
16S-2 = jumlah electron = 16 + 2 = 18
17Cl– = jumlah electron = 17 + 1 = 18
17Cl = jumlah elektron = 17
2. Elektron terakhir atom X memiliki 4 bilangan kuantum sebagai berikut :
n = 4, l = 1, m = 0 , s = -1/2
Nomor atom unsur X tersebut adalah . . . .
A. 20
B. 25
C. 30
D. 35
E. 36
Pembahasan
n = 4 → kulit ke-4
l = 1 → sub kulit p
m = 0 → electron terisi pada orbital tengah
s = – ½ → arah panah ke bawah
Kulit Valensi : 4p5
Konfigurasi electron : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Jumlah electron = 35
Chapter 8
1. Unsur 16T dalam sistem periodik unsur terletak pada golongan dan periode berturut-turut…
A. IVA, periode 3
B. VA, periode 2
C. VIA, periode 3
D. VIIA, periode 3
E. IVB, periode 2
Pembahasan
menentukan letak unsur
Menurut atom Bohr, unsur T memiliki 3 kulit dan 6 elektron valensi maka T terletak pada periode 3 golongan VIA. Hal ini jelas terlihat dari konfigurasi elektronnya.
2. Isotop unsur di bawah ini terdiri dari…
A. 13 proton, 14 elektron, dan 27 neutron
B. 13 proton, 13 elektron, dan 27 neutron
C. 13 proton, 13 elektron, dan 14 neutron
D. 14 proton, 14 elektron, dan 13 neutron
E. 27 proton, 27 elektron, dan 14 neutron
Pembahasan
Jumlah proton, elektron, dan neutron.
Untuk emngerjakan soal seperti ini, kita harus mengingat kembali bagaimana notasi unsur. Notasi unsur pada umumnya ditulis seperti berikut :
A = nomor massa
X = lambang unsur
Z = nomor atom = jumlah proton = jumlah elektron
Jumlah neutron = A – Z
dengan :
A = 27
Z = 13
Jumlah neutron = 27 – 13 = 14.
Maka, dari soal diketahui bahwa isotop tersebut memiliki 13 proton, 13 elektron, dan 14 neutron.
Chapter 9
1. Setiap unsur mampu membentuk ikatan kimia karena memiliki ….
A. Elekcron valensi
B. Kecendrungan membentuk konfigurasi electron gas mulia
C. Lintasan electron
D. Neutron dalam inti atom
E. Proton dan neutron
Pembahasan
Unsur-unsur gas mulia sukar bereaksi karena unsur-unsur tersebut tergolong unsur yang stabil. Menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Setiap atom dalam pembentukan senyawa membentuk konfigurasi electron yang stabil, yaitu :
· Konfigurasi electron gas mulia yang disebut konfigurasi octet atau kaidah oktet,
· Sedangkan Helium disebut kaidah duplet.
Atom-atom suatu unsur berusaha mencapai konfigurasi octet atau duplet dengan cara berikatan dengan atom-atom lain.
Ikatan yang terjadi dapat berupa ikatan ion, kovalen dan kovalen koordinasi.
2. Di antara zat berikut ini, yang mengandung ikatan ion adalah:
A. Es batu
B. Silikon
C. Perunggu
D. Batu kapur
E. Gula
Pembahasan
Batu kapur mengandung ikatan ion karena rumus senyawa batu kapur adalah CaSO4. Dimana dalam senyawa tersebut terdapat unsur Ca yang merupakan logam. Es batu merupakan air, silikon bukan logam, gula juga bukan merupakan logam. Dan juga
Ca2+ + SO42-→ CaSO4
Logam + non logam = ikatan ion
Chapter 10
1. Molekul dengan orbital hibrida sp² memiliki bentuk orbital …
A. Linear
B. Segitiga datar
C. Segitiga piramida
D. Tetrahedral
E. Oktahedral
Pembahasan
Segitiga datar atau trigonal planar merupakan bentuk molekul sp²
2. Bentuk molekul NH3 (7N dan 1H) adalah …
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Segitiga piramida
E. Segitiga bipiramida
Pembahasan
Konfigurasi elektron kulit utama
₇N = 2 . 5
₁H = 2
Atom N membutuhkan 3 elektron untuk mencapai kestabilan oktet.
Atom H membutuhkan 1 elektron untuk mencapai kestabilan duplet.
Pada senyawa amonia atau NH₃, atom N bertindak sebagai atom pusat yang berikatan dengan 3 buah atom H. Sebagai sesama non logam dan menggunakan elektron bersama, jenis ikatan yang terjadi adalah ikatan kovalen.
Setelah atom pusat N mencapai oktet, masih ada sepasang elektron bebas milik N. Perhatikan mekanisme selanjutnya.
Domain elektron ikatan atau disebut juga pasangan elektron ikatan (PEI) = 3. Terjadi antara atom pusat N yang berikatan 3 buah atom H.
Domain elektron bebas atau disebut juga pasangan elektron bebas (PEB) = 1, merupakan pasangan elektron bebas milik atom pusat N.
Antara sepasang elektron bebas atom pusat N dengan tiga pasang elektron ikatan atom H terjadi interaksi tolak-menolak.
Tipe molekul adalah soal bentuk molekul
A = atom pusat ⇒ N
X = pasangan elektron ikatan (PEI)
m = jumlah PEI ⇒ 3 (atau terikat dengan 3 atom H)
E = pasangan elektron bebas (PEB)
n = jumlah PEB ⇒ 1
Dengan demikian tipe molekulnya adalah soal bentuk molekul
Bentuk molekulnya adalah trigonal piramida atau boleh disebut juga segitiga piramida.
Chapter 11
1. Manakah molekul yang memiliki gaya tarik-menarik dipol-dipole antarmolekulnya? (Gunakan tabel periodik yang tersedia)
A. AsH3
B. BCl3
C. Cl2
D. CO2
E. XeF4
Pembahasan
Molekul-molekul akan memiliki gaya dipol-dipol bila molekul tersebut bersifat polar.
Setiap atom kebanyakan akan stabil bila elektron valensinya berjumlah 8 atau 2. Untuk senyawa kovalen bisa dicapai dengan menggunakan pasangan elektron bersama atom-atom lain.
AsH3:
As atom pusat (jumlahnya hanya 1 atom).
As mempunyai e-valensi 5
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 5 – (3 × 1) = 5 – 3 = 2
PEB = jumlah EB/2 = 2/2 = 1 → E1
Keterangan EB = elektron bebas, PEB = pasangan elektron bebas
AsH3→ sistem AX3E1 atau AX3E
AX3E → Bentuk molekul piramida segitga → polar
BCl3:
B atom pusat (jumlahnya hanya 1 atom).
B mempunyai e-valensi 3
Cl atom luar dengan e-valensi 7
Cl merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
Cl berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 3 – (3 × 1) = 3 – 3 = 0
PEB = 0 → E0
BCl3→ sistem AX3E0 atau AX3
AX3→ Bentuk molekul segitiga datar → nonpolar
CO2:
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
O atom luar dengan e-valensi 6
O merupakan atom divalen (perlu 2 elektron lagi untuk stabil)
O berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (2 × 2) = 4 – 4 = 0
PEB = 0 → E0
CO2→ sistem AX4E0 atau AX4
AX4→ Bentuk molekul tetrahedral → nonpolar
Cl2:
Cl2 atau Cl – Cl → molekul diatomik → nonpolar.
XeF4:
Xe atom pusat (jumlahnya hanya 1 atom).
Xe mempunyai e-valensi 8
F atom luar dengan e-valensi 7
F merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
F berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 8 – (4 × 1) = 8 – 4 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
XeF4→ sistem AX3E2
AX3E2 → Bentuk molekul segiempat datar → nonpolar
Kesimpulan, dari pilihan molekul yang tersedia hanya AsH3 yang bersifat polar. Jadi yang memiliki gaya tarik menarik adalah AsH3 saja. Molekul lain semua bersifat nonpolar, tidak punya gaya dipol-dipol.
2. Ketika NaCl larut dalam air, menghasilkan Na+ dan Cl– sebagai larutan. Gaya tarik menarik yang terjadi antara Na+ dan air disebut interaksi.....
A. dipol-dipol
B. ion-ion
C. ikatan hidrogen
D. ion-dipol
E. gaya dispersi.
Pembahasan
Dengan menyimak tabel berikut maka dengan jelas dapat ditentukan. Jawaban yang tepat D. Ion-dipol.







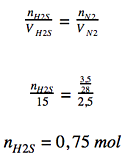








Tidak ada komentar:
Posting Komentar