Polimer Organik Sintesis dan Alami
1. Tujuan [kembali]
- Untuk mengetahui apa itu Polimer
- Untuk memahami materi tentang polimer
- Untuk memahami macam macam polimer
- Chang, R. and Goldsby, K.A.(2016), Chemistry, Twelfth edition, Mc.Graw-Hill education, Florida State University.
25.1 Sifat Polimer
Polimer adalah senyawa molekuler yang dibedakan dengan massa molar yang tinggi, berkisar hingga ribuan dan jutaan gram, dan terdiri dari banyak unit berulang. Fisik sifat dari apa yang disebut makromolekul ini sangat berbeda dari yang kecil, biasa molekul, dan teknik khusus diperlukan untuk mempelajarinya.
Polimer yang terjadi secara alami termasuk protein, asam nukleat, selulosa (polisakarida), dan karet (polyisoprene). Kebanyakan polimer sintetik adalah senyawa organik. Contoh yang sudah dikenal adalah nilon, poli (heksametilen adipamida); Dacron, poli (etilen
tereftalat); dan Lucite atau Plexiglas, poli (metil metakrilat).
Variabel berikut dapat dikontrol saat memproduksi polimer.
- Monomer terpolimerisasi atau monomer yang dikopolimerisasi.
- Reagen yang digunakan untuk memulai reaksi polimerisasi.
- Identitas dan jumlah reagen yang digunakan untuk mengikat silang rantai polimer.
- Suhu dan tekanan saat polimerisasi terjadi.
- Pelarut tempat monomer dipolimerisasi.
- Cara polimer dikumpulkan, yang dapat menghasilkan penyejajaran rantai polimer yang kurang lebih acak atau kain yang rantai-rantai tersebut sejajar dalam satu arah.
Mengubah satu atau lebih parameter ini dapat mempengaruhi linieritas polimer, berat molekul rata-rata, taktis rantai samping pada tulang punggung polimer, dan kerapatan produk.
Dimungkinkan juga untuk mengubah sifat polimer dengan menambahkan stabilisator atau pemlastis. Stabilizer digunakan untuk meningkatkan kemampuan plastik dalam menahan oksidasi, membuatnya kurang sensitif terhadap panas atau cahaya, atau sebagai penghambat api. Pemlastis meningkatkan fleksibilitas plastik dengan bertindak sebagai pelumas, mengurangi gesekan antar molekul saat satu rantai polimer bergerak melewati rantai polimer lainnya. Mereka juga meningkatkan jumlah ruang kosong - yang disebut volume bebas - di dalam polimer dengan membuka ruang di antara rantai polimer untuk meningkatkan kemudahan ujung rantai, rantai samping, dan rantai utama dapat bergerak.
Hasil dari semua manipulasi ini bisa berupa polimer sekuat Kevlar, yang digunakan untuk membuat rompi anti peluru, atau bahan yang mudah robek seperti selembar kertas. Ini bisa sekeras bola bowling atau selembut selembar kertas tisu. Ini bisa rapuh seperti gelas polistiren sekali pakai yang digunakan di pesta atau seelastis cangkir kopi Styrofoam.
Daftar berikut menjelaskan beberapa sifat penting polimer
Kapasitas panas / Konduktivitas panas - Sejauh mana plastik atau polimer bertindak sebagai insulator yang efektif terhadap aliran panas. (Polistiren dalam gelas plastik sekali pakai bukanlah isolator yang baik. Namun, meniup udara melalui stirena saat sedang dipolimerisasi menghasilkan Styrofoam yang digunakan untuk cangkir kopi sekali pakai, yang merupakan isolator yang jauh lebih baik.)
Ekspansi termal - Sejauh mana polimer mengembang atau berkontraksi saat dipanaskan atau didinginkan. (Silikon sering digunakan untuk menutup jendela kaca pada bingkainya karena silikon memiliki koefisien muai panas yang sangat rendah.) Muai panas juga berkaitan dengan pertanyaan apakah polimer mengembang atau menyusut dengan jumlah yang sama ke segala arah. (Polimer biasanya anisotropik. Polimer mengandung ikatan kovalen yang kuat di sepanjang rantai polimer dan gaya dispersif yang jauh lebih lemah antara rantai polimer. Akibatnya, polimer dapat mengembang dengan jumlah yang berbeda ke arah yang berbeda.)
Kristalinitas - Sejauh mana rantai polimer diatur dalam struktur biasa dan bukan secara acak. (Beberapa polimer, seperti Silly Putty dan Play Dough, terlalu amorf dan kekurangan kekakuan yang diperlukan untuk membuat produk yang berguna. Polimer yang terlalu kristalin seringkali juga terlalu rapuh.)
Permeabilitas - Kecenderungan polimer untuk melewatkan bahan asing. (Polietilen digunakan untuk membungkus makanan karena 4000 kali lebih sedikit permeabel terhadap oksigen daripada polistiren.)
Modulus elastis - Gaya yang diperlukan untuk meregangkan plastik ke satu arah.
Kekuatan tarik - Kekuatan plastik. (Gaya yang harus diterapkan ke satu arah untuk meregangkan plastik hingga pecah.)
Ketahanan - Kemampuan plastik untuk menahan abrasi dan keausan.
Indeks bias - Sejauh mana plastik mempengaruhi cahaya saat melewati polimer. (Apakah itu melewatkan cahaya seperti PMMA, atau apakah itu menyerap cahaya seperti PVC?)
Resistensi terhadap arus listrik - Apakah material merupakan isolator, seperti kebanyakan polimer, atau apakah ia menghantarkan arus listrik? (Ada minat yang berkembang dalam polimer konduksi, yang dapat diisi dan dilepaskan, dan polimer fotokonduktor yang dapat mengambil muatan listrik saat terkena cahaya.)
25.2 Polimer Organik Sintetis
Karena ukurannya, kita mungkin mengira molekul yang mengandung ribuan atom karbon dan hidrogen membentuk sejumlah besar isomer struktural dan geometris (jika C “ Ada ikatan C). Namun, molekul-molekul ini tersusun dari monomer, unit berulang sederhana, dan jenis komposisi ini sangat membatasi jumlah kemungkinan isomer. Polimer sintetik dibuat dengan menggabungkan monomer satu per satu, melalui reaksi adisi dan reaksi kondensasi.
Reaksi Penambahan
Reaksi adisi melibatkan senyawa tak jenuh yang mengandung ikatan rangkap atau rangkap tiga, terutama dan
dan . Hidrogenasi dan reaksi hidrogen halida dan halogen dengan alkena dan alkuna adalah contoh reaksi adisi.
. Hidrogenasi dan reaksi hidrogen halida dan halogen dengan alkena dan alkuna adalah contoh reaksi adisi.
 dan
dan . Hidrogenasi dan reaksi hidrogen halida dan halogen dengan alkena dan alkuna adalah contoh reaksi adisi.
. Hidrogenasi dan reaksi hidrogen halida dan halogen dengan alkena dan alkuna adalah contoh reaksi adisi.Polietilen, polimer sangat stabil yang digunakan dalam bungkus kemasan, dibuat dengan menggabungkan monomer etilena melalui mekanisme reaksi adisi. Pertama sebuah pemrakarsa molekul (R 2) dipanaskan untuk menghasilkan dua radikal:
Radikal reaktif menyerang molekul etilen untuk menghasilkan radikal baru:
yang selanjutnya bereaksi dengan molekul etilen lain, dan seterusnya:
Dengan sangat cepat rantai CH yang panjang 2 kelompok dibangun. Akhirnya, proses ini diakhiri dengan kombinasi dua radikal rantai panjang untuk menghasilkan polimer yang dipanggil polietilen:
 adalah konvensi singkatan yang nyaman untuk merepresentasikan unit berulang di polimer. Nilai dari n dipahami sangat besar, di pesanan ratusan. Rantai individu polietilen terkumpul dengan baik dan dengan demikian menjelaskan sifat kristal zat (Gambar 25.1). Polietilen terutama digunakan dalam film, dalam kemasan makanan beku dan pembungkus produk lainnya. Jenis polietilen yang dirawat secara khusus yang disebut Tyvek digunakan untuk isolasi rumah. Polyethylene adalah contoh dari a homopolimer, yang mana polimer yang hanya terdiri dari satu jenis monomer. Homopolimer lain yang disintesis oleh mekanisme radikal adalah Teflon, polytetrafluoroethylene (Gambar 25.2) dan poli (vinil klorida) (PVC):
adalah konvensi singkatan yang nyaman untuk merepresentasikan unit berulang di polimer. Nilai dari n dipahami sangat besar, di pesanan ratusan. Rantai individu polietilen terkumpul dengan baik dan dengan demikian menjelaskan sifat kristal zat (Gambar 25.1). Polietilen terutama digunakan dalam film, dalam kemasan makanan beku dan pembungkus produk lainnya. Jenis polietilen yang dirawat secara khusus yang disebut Tyvek digunakan untuk isolasi rumah. Polyethylene adalah contoh dari a homopolimer, yang mana polimer yang hanya terdiri dari satu jenis monomer. Homopolimer lain yang disintesis oleh mekanisme radikal adalah Teflon, polytetrafluoroethylene (Gambar 25.2) dan poli (vinil klorida) (PVC):Beberapa isomer geometri dapat dihasilkan dari reaksi penambahan propena (Gambar 25.3). Jika penambahan terjadi secara acak, kami memperoleh ataktik polipropen, yang tidak menyatu dengan baik. Polimer ini bersifat kenyal, amorf, dan relatif lemah. Dua kemungkinan lainnya adalah isotaktik struktur, di mana semua grup R berada di sisi yang sama.
dari atom karbon asimetris, dan a syndiotactic bentuk, di mana gugus R bergantian ke kiri dan kanan dari karbon asimetris. Dari jumlah tersebut, isomer isotaktik memiliki titik leleh tertinggi dan kristalinitas terbesar dan diberkahi dengan sifat mekanik yang superior.
dari atom karbon asimetris, dan a syndiotactic bentuk, di mana gugus R bergantian ke kiri dan kanan dari karbon asimetris. Dari jumlah tersebut, isomer isotaktik memiliki titik leleh tertinggi dan kristalinitas terbesar dan diberkahi dengan sifat mekanik yang superior.
Masalah utama yang dihadapi industri polimer pada awalnya adalah bagaimana mensintesis polimer isotaktik atau sintaksis secara selektif tanpa membuatnya terkontaminasi oleh produk lain. Solusinya datang dari Giulio Natta † dan Karl Ziegler, ‡ yang mendemonstrasikan katalis tertentu, termasuk trietilaluminum [Al(C2H5)3] dan titanium triklorida (TiCl 3), mempromosikan pembentukan hanya isomer tertentu. Dengan menggunakan katalis Natta-Ziegler, ahli kimia dapat mendesain polimer agar sesuai dengan tujuan apapun.
Karet mungkin merupakan polimer organik paling terkenal dan satu-satunya polimer hidrokarbon sejati yang ditemukan di alam. Ini dibentuk oleh penambahan radikal dari monomer isoprena. Sebenarnya, polimerisasi dapat menghasilkan poli- cis- isoprena atau poli- trans- isoprena — atau campuran keduanya, bergantung pada kondisi reaksi:
Perhatikan bahwa di cis isomer dua CH 2 kelompok berada di sisi yang sama dari C “ Ikatan C, sedangkan kelompok yang sama saling berhadapan di trans isomer. Natkaret ural adalah poli- cis- isoprena, yang diekstrak dari pohon Hevea brasiliensis (Gambar 25.4).
Sifat karet yang tidak biasa dan sangat berguna adalah elastisitasnya. Karet akan meregang hingga 10 kali panjangnya dan jika dilepas akan kembali ke ukuran aslinya. Sebaliknya, sepotong kawat tembaga hanya dapat diregangkan sebagian kecil dari panjangnya dan masih dapat kembali ke ukuran aslinya. Karet yang tidak direntangkan tidak memiliki pola difraksi sinar-X yang teratur dan oleh karena itu bersifat amorf. Namun, karet yang direntangkan memiliki kristalinitas dan keteraturan yang cukup banyak.
Kebanyakan karet sintetis (disebut elastomer) terbuat dari produk minyak bumi seperti etilen, propena, dan butadiena. Misalnya, molekul kloroprena mudah terpolimerisasi untuk membentuk polikloroprena, umumnya dikenal sebagai neoprene, yang memiliki sifat-sifat yang sebanding atau bahkan lebih unggul dari karet alam:
Karet sintetis penting lainnya dibentuk dengan penambahan butadiene ke stirena dengan perbandingan 3: 1 untuk menghasilkan karet stirena-butadiena (SBR). Karena stirena dan butadiene adalah monomer yang berbeda, SBR disebut a kopolimer, yang mana polimer yang mengandung dua atau lebih monomer berbeda. Tabel 25.1 menunjukkan sejumlah homopolimer yang umum dan familiar dan satu kopolimer yang dihasilkan oleh reaksi adisi.
Sifat karet yang tidak biasa dan sangat berguna adalah elastisitasnya. Karet akan meregang hingga 10 kali panjangnya dan jika dilepas akan kembali ke ukuran aslinya. Sebaliknya, sepotong kawat tembaga hanya dapat diregangkan sebagian kecil dari panjangnya dan masih dapat kembali ke ukuran aslinya. Karet yang tidak direntangkan tidak memiliki pola difraksi sinar-X yang teratur dan oleh karena itu bersifat amorf. Namun, karet yang direntangkan memiliki kristalinitas dan keteraturan yang cukup banyak.
Kebanyakan karet sintetis (disebut elastomer) terbuat dari produk minyak bumi seperti etilen, propena, dan butadiena. Misalnya, molekul kloroprena mudah terpolimerisasi untuk membentuk polikloroprena, umumnya dikenal sebagai neoprene, yang memiliki sifat-sifat yang sebanding atau bahkan lebih unggul dari karet alam:
Karet sintetis penting lainnya dibentuk dengan penambahan butadiene ke stirena dengan perbandingan 3: 1 untuk menghasilkan karet stirena-butadiena (SBR). Karena stirena dan butadiene adalah monomer yang berbeda, SBR disebut a kopolimer, yang mana polimer yang mengandung dua atau lebih monomer berbeda. Tabel 25.1 menunjukkan sejumlah homopolimer yang umum dan familiar dan satu kopolimer yang dihasilkan oleh reaksi adisi.
Reaksi Kondensasi
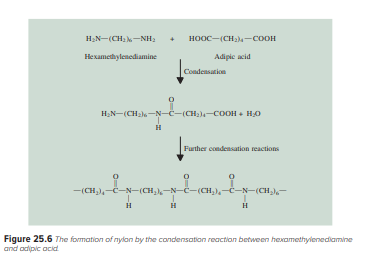
Salah satu proses kondensasi polimer yang paling terkenal adalah reaksi antara heksametilenadiamina dan asam adipat, yang ditunjukkan pada Gambar 25.6. Produk akhir, yang disebut nilon 66 (karena masing-masing terdapat enam atom karbon dalam heksametilenadiamina dan asam adipat), pertama kali dibuat oleh Wallace Carothers. † di Du Pont pada tahun 1931. Keserbagunaan nilon sangat besar sehingga produksi tahunan nilon dan zat terkait sekarang mencapai beberapa miliar pound. Gambar 25.7 menunjukkan bagaimana nilon 66 disiapkan di laboratorium.
Reaksi kondensasi juga digunakan dalam pembuatan Dacron (polyester) 25.3 Protein
Protein adalah polimer dari asam amino; mereka memainkan peran kunci dalam hampir semua proses biologis. Enzim, katalisator reaksi biokimia, sebagian besar adalah protein. Protein juga memfasilitasi berbagai fungsi lain, seperti transportasi dan penyimpanan zat penting, gerakan terkoordinasi, dukungan mekanis, dan perlindungan terhadap penyakit. Tubuh manusia diperkirakan mengandung 100.000 jenis protein, yang masing-masing memiliki fungsi fisiologis tertentu. Seperti yang akan kita lihat di bagian ini, komposisi dan struktur kimia dari polimer alami kompleks ini adalah dasar dari spesifisitasnya.
Asam amino
Protein memiliki massa molar yang tinggi, berkisar dari sekitar namun komposisi persen berdasarkan massa unsur-unsur dalam protein sangat konstan: karbon, 50 sampai 55 persen; hidrogen, 7 persen; oksigen, 23 persen; nitrogen, 16 persen; dan belerang 1 persen.
namun komposisi persen berdasarkan massa unsur-unsur dalam protein sangat konstan: karbon, 50 sampai 55 persen; hidrogen, 7 persen; oksigen, 23 persen; nitrogen, 16 persen; dan belerang 1 persen.
 namun komposisi persen berdasarkan massa unsur-unsur dalam protein sangat konstan: karbon, 50 sampai 55 persen; hidrogen, 7 persen; oksigen, 23 persen; nitrogen, 16 persen; dan belerang 1 persen.
namun komposisi persen berdasarkan massa unsur-unsur dalam protein sangat konstan: karbon, 50 sampai 55 persen; hidrogen, 7 persen; oksigen, 23 persen; nitrogen, 16 persen; dan belerang 1 persen. Unit struktural dasar protein adalah asam amino. Sebuah Asam amino adalah sebuah compon yang mengandung setidaknya satu gugus amino ( ¬ NH 2) dan setidaknya satu kelompok karboksil ( ¬ COOH):
Dua puluh asam amino berbeda adalah bahan penyusun semua protein dalam tubuh manusia. Tabel 25.2 menunjukkan struktur senyawa vital ini, bersama dengan singkatan tiga hurufnya.
Asam amino dalam larutan pada pH netral ada sebagai ion dipolar, artinya proton pada gugus karboksil telah bermigrasi ke gugus amino. Pertimbangkan glisin, asam amino paling sederhana. Bentuk tak terionisasi dan ion dipolar glisin ditunjukkan di bawah ini:
Asam amino dalam larutan pada pH netral ada sebagai ion dipolar, artinya proton pada gugus karboksil telah bermigrasi ke gugus amino. Pertimbangkan glisin, asam amino paling sederhana. Bentuk tak terionisasi dan ion dipolar glisin ditunjukkan di bawah ini:
Langkah pertama dalam sintesis molekul protein adalah reaksi kondensasi antara gugus amino pada satu asam amino dan gugus karboksil pada asam amino lain. Molekul yang terbentuk dari dua asam amino disebut a dipeptida, dan ikatan yang menyatukan mereka adalah a ikatan peptida:
dimana R 1 dan R 2 mewakili atom H atau kelompok lain; ¬ BERSAMA ¬ NH ¬ ( area yang diarsir dalam reaksi di atas) juga disebut kelompok amida. Karena kesetimbangan dari reaksi yang menggabungkan dua asam amino terletak di sebelah kiri, proses tersebut digabungkan dengan hidrolisis ATP (lihat hal. 802).
Salah satu ujung dipeptida dapat terlibat dalam reaksi kondensasi dengan asam amino lain untuk membentuk a tripeptida, Sebuah tetrapeptida, dan seterusnya. Produk akhir, molekul protein, adalah a polipeptida; itu juga dapat dianggap sebagai polimer asam amino.
Unit asam amino dalam rantai polipeptida disebut a residu. Biasanya, rantai polipeptida mengandung 100 atau lebih residu asam amino. Urutan asam amino dalam rantai polipeptida ditulis secara konvensional dari kiri ke kanan, dimulai dengan residu terminal-amino dan diakhiri dengan residu terminal-karboksil.
Struktur Protein
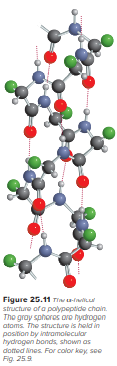
Jenis dan jumlah asam amino dalam suatu protein bersama dengan urutan atau urutan di mana asam amino ini bergabung menentukan struktur protein. Pada tahun 1930-an, Linus Pauling dan rekan kerjanya melakukan penyelidikan sistematis terhadap struktur protein. Pertama, mereka mempelajari geometri dari kelompok pengulangan dasar, yaitu kelompok amida, yang diwakili oleh struktur resonansi berikut:
Terlepas dari semua gaya yang memberi protein stabilitas strukturalnya, kebanyakan protein memiliki sejumlah fleksibilitas. Enzim, misalnya, cukup fleksibel untuk mengubah geometrinya agar sesuai dengan substrat dengan berbagai ukuran dan bentuk.
struktur (Gambar 25.15). Diyakini bahwa Fe 2 1 ion memiliki radius yang terlalu besar untuk muat ke dalam cincin porfirin deoxyhemoglobin. Saat O 2 mengikat Fe 2 1, namun, ion tersebut menyusut agak sehingga bisa masuk ke dalam bidang cincin. Saat ion masuk cincin, itu menarik residu histidin ke arah cincin dan dengan demikian memicu urutan perubahan struktural dari satu subunit ke subunit lainnya. Meskipun detail perubahannya tidak jelas, ahli biokimia percaya bahwa inilah cara pengikatan molekul oksigen ke satu kelompok heme mempengaruhi kelompok heme lainnya. Perubahan struktural secara drastis mempengaruhi afinitas kelompok heme yang tersisa untuk molekul oksigen.
Ketika protein dipanaskan di atas suhu tubuh atau ketika mengalami kondisi asam atau basa yang tidak biasa atau diolah dengan reagen khusus yang disebut denaturants, biasa atau diolah dengan reagen khusus yang disebut denaturants, mereka kehilangan sebagian atau seluruh struktur tersier dan sekundernya. Dipanggil protein terdenaturasi, protein dalam keadaan ini tidak lagi menunjukkan aktivitas biologis normal. Gambar 25.16 menunjukkan variasi kecepatan dengan suhu untuk reaksi katalis enzim yang khas. Awalnya, kecepatan meningkat dengan meningkatnya suhu, seperti yang kita perkirakan. Namun, di luar suhu optimal, enzim mulai mengubah sifat dan kecepatannya turun dengan cepat. Jika protein diubah sifatnya dalam kondisi ringan, struktur aslinya sering kali dapat dibuat ulang dengan menghilangkan denaturant atau dengan mengembalikan suhu ke kondisi normal. Proses ini disebut denaturasi reversibel.
25.4 Asam Nukleat
Asam nukleat adalah polimer bermassa molar tinggi yang memainkan peran penting dalam sintesis protein. Asam deoksiribonukleat (DNA) dan asam ribonukleat (RNA) adalah dua jenis asam nukleat. Molekul DNA adalah salah satu molekul terbesar yang diketahui; mereka memiliki massa molar hingga puluhan miliar gram. Di sisi lain, molekul RNA sangat bervariasi ukurannya, beberapa memiliki massa molar sekitar 25.000 g. Dibandingkan dengan protein, yang terdiri dari hingga 20 asam amino berbeda, asam nukleat memiliki komposisi yang cukup sederhana. Molekul DNA atau RNA hanya berisi empat jenis blok pembangun: purin, pirimidin, gula furanosa, dan gugus fosfat (Gambar 25.17). Setiap purin atau pirimidin disebut a mendasarkan.
Pada 1940-an, Erwin Chargaff † mempelajari molekul DNA yang diperoleh dari berbagai sumber dan mengamati keteraturan tertentu. Aturan Chargaff, karena temuannya sekarang diketahui, gambarkan pola-pola ini:
- Jumlah adenin (purin) sama dengan timin (pirimidin); itu adalah 5 T, atau A / T 5 1.
- Jumlah sitosin (pirimidin) sama dengan guanin (purin); yaitu, C 5 G, atau C / G 5 1.
- Jumlah total basa purin sama dengan jumlah total basa pirimidin; itu adalah 1 G 5 C 1 T.
Berdasarkan analisis kimia dan informasi yang diperoleh dari pengukuran difraksi sinar-X, James Watson † dan Francis Crick ‡ merumuskan struktur heliks ganda untuk molekul DNA pada tahun 1953. Watson dan Crick menentukan bahwa molekul DNA memiliki dua untai heliks. Setiap untai terdiri dari nukleotida, yang terdiri dari basa, deoksiribosa, dan gugus fosfat yang saling terkait.
Kunci struktur heliks ganda DNA adalah pembentukan ikatan hidrogen antara basa di dua untai molekul. Meskipun ikatan hidrogen dapat terbentuk antara dua basa, disebut pasangan basa, Watson dan Crick menemukan bahwa kopling yang paling menguntungkan adalah antara adenin dan timin serta antara sitosin dan guanine. Perhatikan bahwa skema ini konsisten dengan aturan Chargaff, karena setiap basa purin terikat hidrogen ke basa pirimidin, dan sebaliknya (A 1 G 5 C 1 T). Gaya atraktif lainnya seperti interaksi dipol-dipol dan gaya van der Waals antara pasangan basa juga membantu menstabilkan heliks ganda.
Struktur RNA berbeda dari DNA dalam beberapa hal. Pertama, seperti yang ditunjukkan pada Gambar 25.17, empat basa yang ditemukan dalam molekul RNA adalah adenin, sitosin, guanin, dan urasil. Kedua, RNA mengandung ribosa gula daripada DNA 2-deoksiribosa. Ketiga, analisis kimiawi menunjukkan bahwa komposisi RNA tidak sesuai dengan aturan Chargaff. Dengan kata lain, rasio purin-pirimidin tidak sama dengan 1 seperti pada DNA. Ini dan bukti lainnya mengesampingkan struktur heliks ganda. Faktanya, molekul RNA ada sebagai polinukleotida untai tunggal. Sebenarnya ada tiga jenis molekul RNA — messenger RNA ( m RNA), RNA ribosom ( r RNA), dan transfer RNA ( t RNA). RNA ini memiliki nukleotida yang serupa tetapi berbeda satu sama lain dalam hal massa molar, struktur keseluruhan, dan fungsi biologis.
Molekul DNA dan RNA mengarahkan sintesis protein di dalam sel, subjek yang berada di luar cakupan buku ini. Teks pengantar dalam biokimia dan biologi molekuler menjelaskan proses ini.
Logicstate berubah menjadi angka satu menunjukkan bahwa sensor mendeteksi adanya gas. sinyal tersebut di teruskan menuju transistor dan diberi daya 5V. dan di teruskan menuju relay. diteruskan ke motor sebagai penggerak kipas untuk menghilangkan gas diudara. dan buzzer sebagai bel peringatan untuk keluar dari suatu ruangan yang sudah terkontaminasi gas.
6. Video [kembali]
7. Download File [kembali]






























Tidak ada komentar:
Posting Komentar