1. Tujuan [kembali]
- Untuk memahami sifak sifat fisik larutan
- Untuk meringkas materi BAB 12
2. Alat dan Bahan[kembali]
- Chang, R. and Goldsby, K.A.(2016), Chemistry, Twelfth edition, Mc.Graw-Hill education, Florida State University.
3. Dasar Teori [kembali]
Sifat Sifat Fisik Larutan
12.1 Jenis Jenis Larutan
Larutan adalah campuran homogen dari dua atau lebih zat.
Zat yang lebih sediikt adalah zat terlarut.
Zat yang lebih banyak adalah zat pelarut
Kimiawan juga mengkarekterisasi larutan berdasarkan kapasitasnya untuk melarutkan zat terlarut.
- Larutan Jenuh mengandung jumlah maksimum zat telarut yang dapat larut dalam suatu pelarut pada suhu tertentu
- Larutan tak jenuh mengandung lebih sedikit zat terlarut daripada yang dimilikinya untuk larut.
- Larutan lewat-jenuh menganding zat terlarut lebih banyak daripada yang terdapat dalam larutan jenuh pada suhu tertentu.
Pada waktunya, beberapa zat terlarut akan keluar dari larutan jenuh sebagai krital. Kritalisasi adalah proses dimana zat terlarut akan keluar dari larutan dan membentuk kristal.
12.2. Pandangan Molekuler dari Proses Larutan
Gaya tarik antarmolekul yang menahan molekul bersama dalam cairan dan padatan juga memainkan peran sentral dalam pembentukan larutan. Ketika satu zat (zat terlarut) larut dalam zat lain (pelarut), partikel zat terlarut menyebar ke seluruh pelarut. Partikel zat terlarut menempati posisi yang biasanya diambil oleh molekul pelarut. Kemudahan partikel zat terlarut menggantikan molekul pelarut bergantung pada kekuatan relatif dari tiga jenis interaksi:
- Interaksi pelarut-pelarut
- Interaksi zat terlarut-zat terlarut
- Interaksi pelarut-zat terlarut
Proses larutan
1. Molekul pelarut terpisah
2. Molekul zat terlarut terpisah
3. Campuran molekul pelarut dan terlarut
Jika tarikan pelarut-terlarut lebih kuat dari daya tarik pelarut-plearut dan daya tarik zat terlarut-terlarut, proses larutannya besifat eksotermik.
Jika tarikan pelarut-terlarut lebih lemah dari daya tarik pelarut-plearut dan daya tarik zat terlarut-terlarut, proses larutannya bersifat endodermik.
Fakta menarik:
- Gaya tarik antarmolekul yang menyatukan molekul dalam cairan dan padatan juga memainkan peran sentral dalam pembentukan larutan.
- Partikel zat terlarut selalu menyebar ke seluruh pelarut.
- Proses pencampuran bisa eksotermik atau endotermik.
- Dua zat dengan gaya antarmolekul yang sama cenderung dapat larut satu sama lain.
- Senyawa ionik biasanya memiliki kelarutan yang sangat rendah dalam pelarut nonpolar.
Proses larutan diatur oleh dua faktor
1. energi
2. kecenderungan yang melekat pada ketidakteraturan di semua peristiwa alam
.
12.3 Unit Konsentrasi
Konsentrasi suatu larutan hanyalah jumlah zat terlarut dalam jumlah larutan tertentu. Empat unit konsentrasi paling umum yang digunakan ahli kimia dalam studi kuantitatif meliputi:
1. Persen massa
2. Fraksi mol
3. Molaritas
4. Molalitas
Cara mengetahui satuan konsentrasi yang harus dipilih.
Mengetahui unit konsentrasi mana yang harus dipilih hanyalah masalah mengetahui tujuan eksperimen atau apa yang Anda coba pecahkan. Misalnya, jika Anda memecahkan masalah yang berhubungan dengan tekanan parsial gas menggunakan fraksi mol akan sesuai, tetapi tidak untuk titrasi atau analisis gravimetri.
Molaritas vs Molalitas
Molaritas dan molalitas masing-masing lebih disukai daripada yang lain dalam kasus tertentu. Menggunakan labu ukur untuk mengukur volume larutan lebih mudah daripada menimbang pelarut dan oleh karena itu molaritas akan menjadi satuan konsentrasi yang lebih disukai. Namun penting untuk diingat bahwa dengan meningkatnya suhu, volume juga akan meningkat. Hal ini dapat mengancam validitas eksperimen dan terjadi karena penghitungan yang tidak akurat. Molalitas tidak bergantung pada suhu dan dalam hal ini akan menjadi satuan konsentrasi yang digunakan sebagai pengganti molaritas.Dalam beberapa kasus, pengubahan ke satu unit konsentrasi dari suatu larutan ke yang lain akan diperlukan.
12.4 Pengaruh Temperatur pada larutan
Suhu dan kelarutan
Hampir semua kelarutan zat dipengaruhi oleh suhu. Dalam beberapa keadaan, kelarutan zat padat meningkat seiring suhu. Reaksi eksotermik dan endotermik seperti pada CACL2 dan NH4NO3 menunjukkan bahwa kelarutannya meningkat dengan meningkatnya suhu. Eksperimen dilakukan untuk melangkah lebih jauh dan menguji efek temperatur dan kelarutan.
Kristalisasi Fraksional
adalah pemisahan campuran zat murni berdasarkan kelarutannya yang berbeda.
Ada beberapa senyawa ionik yang kelarutannya dipengaruhi oleh kenaikan suhu. Beberapa senyawa ionik mengalami perubahan kelarutan yang lebih besar dengan meningkatnya suhu seperti pada NaNO3 dibandingkan dengan KCl.
Kristalisasi pecahan digunakan untuk memisahkan campuran zat murni dari campuran berdasarkan kelarutannya yang berbeda. Misalnya jika 90 g KNO3 terkontaminasi dengan 10 g NaCl, metode untuk menghitung berapa banyak KNO3 murni yang akan mengkristal dari larutan adalah kristalisasi fraksional. Sampel KNO3 dilarutkan dalam 100 ml air pada suhu 60 derajat Celcius dan akhirnya diturunkan menjadi 0 derajat celcius. Kelarutan KNO3 pada suhu ini adalah 12,1 g / 100 H20 dan NaCl adalah 34,2 g / 100 H2O. Dengan mengurangi jumlah awal 90 g KNO3 dengan 12 g, kita mendapatkan total 78 g KNO3 yang akan mengkristal dari larutan. Dengan melakukan ini dapat menghitung berapa banyak KNo3 murni yang dimiliki dalam campuran yang terkontaminasi dengan NaCl.
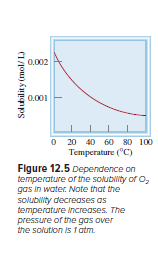
Kelarutan Gas
Peningkatan kelarutan dengan peningkatan suhu ini berlawanan untuk gas. Kelarutan gas dalam H2O menurun dengan meningkatnya suhu. Misalnya ketika air mendidih, Anda dapat melihat gelembung yang terbentuk mewakili "mendidih" dari molekul udara terlarut.
Polusi termal adalah akibat buruk yang dihasilkan melalui pendinginan industri di pembangkit listrik tenaga nuklir. Air dipanaskan dalam proses ini dan kemudian disimpan di sungai dan danau tempat pengambilannya. Ini berdampak negatif pada ikan karena suhu yang cepat mempercepat metabolisme mereka dan pada gilirannya mereka membutuhkan lebih banyak oksigen. Namun, suplai oksigen menurun karena kelarutannya yang lebih rendah dalam air panas.
12.5 Pengaruh tekanan pada kelarutan gas
Hukum Henry menyatakan bahwa kelarutan gas dalam cairan sebanding dengan tekanan gas di atas larutan.
c = konsentrasi molar (mol/L)
k = konstanta (mol/L*atm)
P = tekanan parsial (atm)
Jika P sama dengan 1, c sama dengan k
Pengecualian dari Hukum Henry:
Jika gas terlarut bereaksi dengan air, kelarutan yang lebih tinggi dapat terjadi.
12.6 Sifat koligatif larutan non-elektrolit
adalah sifat yang hanya bergantung pada jumlah partikel zat terlarut dalam larutan dan bukan pada sifat partikel zat terlarut.
Sifat ini terikat bersama oleh asal yang sama — semuanya bergantung
pada jumlah partikel zat terlarut yang ada, terlepas dari apakah mereka atom,
ion, atau molekul.
1. Penurunan tekanan uap
Jika zat terlarut bersifat non-volatil (tidak mudah menguap; tekanan uapnya tidak dapat terukur), tekanan uap dari larutan akan selalu lebih rendah dari tekanan uap pelarut murni yang volatil. Secara ideal, tekanan uap dari pelarut volatil di atas larutan yang mengandung zat terlarut non-volatil berbanding lurus terhadap konsentrasi pelarut dalam larutan. Hubungan dalam sifat koligatif larutan ini dinyatakan secara kuantitatif dalam hukum Raoult: tekanan uap dari pelarut di atas larutan, Plarutan sama dengan hasil kali fraksi mol dari pelarut, Xpelarut dengan tekanan uap dari pelarut murni, P°pelarut. Penurunan tekanan uap, ΔP, yaitu P°pelarut−Plarutan berbanding lurus terhadap fraksi mol dari Xterlarut.
2. Kenaikan titik didih
Titik didih dari suatu larutan adalah temperatur ketika tekanan uapnya sama dengan tekanan eksternal. Oleh karena terjadinya penurunan tekanan uap larutan oleh keberadaan zat terlarut non-volatil, dibutuhkan kenaikan temperatur untuk menaikkan tekanan uap larutan hingga sama dengan tekanan eksternal. Jadi, keberadaan zat terlarut dalam pelarut mengakibatkan terjadinya kenaikan titik didih; titik didih larutan, Tb, lebih tinggi dari titik didih pelarut murni, Tb°. Kenaikan titik didih, ΔTb, yaitu Tb−Tb° berbanding lurus terhadap konsentrasi (molalitas, m) larutan, sebagaimana:
di mana Kb adalah konstanta kenaikan titik didih molal (dalam satuan °C/m) dan m adalah molalitas larutan.
3. Penurunan titik beku
Pada larutan dengan pelarut volatil dan zat terlarut non-volatil, hanya partikel-partikel pelarut yang dapat menguap dari larutan sehingga meninggalkan partikel-partikel zat terlarut. Hal serupa juga terjadi dalam banyak kasus di mana hanya partikel-partikel pelarut yang memadat (membeku), meninggalkan partikel-partikel zat terlarut membentuk larutan yang konsentrasinya lebih pekat. Titik beku dari suatu larutan adalah temperatur di mana tekanan uap larutan sama dengan tekanan uap pelarut murni. Pada temperatur ini, dua fasa – pelarut padat dan larutan cair – berada dalam kesetimbangan.
Oleh karena terjadinya penurunan tekanan uap larutan dari tekanan uap pelarut, larutan membeku pada temperatur yang lebih rendah dibanding titik beku pelarut murni — titik beku larutan, Tf, lebih rendah dari titik beku pelarut murni, Tf°. Dengan kata lain, jumlah partikel-partikel pelarut yang keluar dan masuk padatan yang membeku per satuan waktu menjadi sama pada temperatur yang lebih rendah. Sifat koligatif larutan berupa penurunan titik beku, ΔTf, yaitu Tf° – Tf berbanding lurus terhadap konsentrasi (molalitas, m) larutan, sebagaimana:
dimana Kf adalah konstanta penurunan titik beku molal (dalam satuan °C/m) dan m adalah molalitas larutan.
4. Tekanan osmosis
Ketika dua larutan dengan konsentrasi yang berbeda dipisahkan oleh suatu membran semipermeabel — membran yang hanya dapat dilewati partikel pelarut namun tidak dapat dilewati partikel zat terlarut—maka terjadilah fenomena osmosis. Osmosis adalah peristiwa perpindahan selektif partikel-partikel pelarut melalui membran semipermeabel dari larutan dengan konsentrasi zat terlarut yang lebih rendah ke larutan dengan konsentrasi zat terlarut yang lebih tinggi.
Tekanan osmosis, π, berbanding lurus terhadap jumlah partikel zat terlarut, n, dalam suatu volume larutan tertentu, V—yang merupakan molaritas (M), sebagaimana:
di mana R adalah konstanta gas ideal (0,0821 L.atm/mol.K) dan T adalah temperatur (dalam satuan K).
Menggunakan Sifat Koligatif untuk Menentukan Massa Molar
Sifat koligatif larutan nonelektrolit menyediakan cara untuk menentukan massa molar zat terlarut. Secara teoritis, salah satu dari empat sifat koligatif cocok untuk tujuan ini. Dalam prakteknya, bagaimanapun, hanya depresi titik beku dan tekanan osmotik digunakan karena menunjukkan perubahan yang paling jelas.
Prosedurnya adalah sebagai berikut. Dari titik beku yang ditentukan secara eksperimental depresi atau tekanan osmotik, kita dapat menghitung molalitas atau molaritas dari larutan. Mengetahui massa zat terlarut, kita dapat langsung menentukan massa molar.
12.7 Sifat koligatif larutan elektrolit
van't Hoff factor--
Pasangan Ion - Terdiri dari satu atau lebih kation dan satu atau lebih anion yang disatukan oleh gaya elektrostatis
Konsep dan reaksi utama
Elektrolit terdisosiasi menjadi ion dalam larutan dan satu senyawa elektrolit terpisah menjadi dua atau lebih partikel saat larut. Larutan dengan konsentrasi elektrolit yang tinggi berpeluang menghasilkan pembentukan pasangan ion.
12.8 Koloid
Reaksi, Proses, dan Konsep:
- Partikel terdispersi dalam koloid biasanya lebih besar dari molekul zat terlarut dan memiliki ukuran dari 1X10 ^ 3 hingga 1X10 ^ 6pm. Ini adalah ukuran yang lebih kecil dari partikel yang biasanya terlihat dalam campuran suspensi.
- Koloid tidak memiliki homogenitas larutan biasa.
- Efek Tyndall dapat digunakan untuk membedakan antara koloid dan campuran. Efeknya bisa dilihat jika cahaya putih melewati zat dan tersebar. Cahaya yang berubah menunjukkan koloid karena fase terdispersi dalam campuran terlalu kecil untuk dilihat dan mengganggu prosesnya.
- Koloid bisa berupa cairan, gas, atau kombinasi yang menghasilkan beberapa zat umum.
- Koloid terpenting adalah yang disalurkan ke dalam air. Ada dua jenis, hidrofobik dan hidrofilik. Koloid hidrofilik biasanya merupakan protein karena sifat lipatan protein yang meninggalkan area hidrofilik di luar molekul.
- Koloid hidrofobik biasanya menggumpal (seperti minyak dalam air). Mereka dapat distabilkan dengan penyerapan ion ke permukaan. Ion yang terserap dapat berinteraksi dengan air, menstabilkan koloid.
- Tolakan elektromagnetik antar partikel mencegah mereka menggumpal bersama dalam koloid hidrofilik.
- Koloid hidrofobik juga dapat distabilkan oleh gugus hidrofilik lain dari permukaannya.
4. Rangkaian Simulasi [kembali]
6. Video [kembali]
7. Download File [kembali]
Video 1 [DISINI]
Video 2 [DISINI]
V





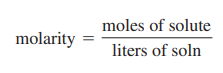



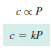








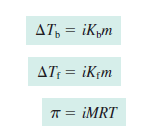






Tidak ada komentar:
Posting Komentar